تاريخ الذرة.. أسرار الجسيمات الدقيقة التي تصنع عالمنا الحديث
لا تُعد الشمس المصدر الأول للطاقة والضوء بالنسبة لكوكبنا فحسب، بل إنّها تهيمن بضخامتها المهيبة على المجموعة الشمسية بكل ما تحتويه من كواكب وأقمار ونيازك، وإذا ما تناولنا نجمنا المفضل الشمس بمنظور الأرض، فإنّنا بحاجة إلى أكثر من مليون جرم سماوي مثل كوكبنا لملء فجوة الشمس.وعلى خلاف ما تبدو عليه في عرض السماء من سكون واستقرار، فهذه الكتلة الضخمة تعيش حالة مستمرة من الهيجان والثوران تتمثل بمقدار الطاقة والحرارة الضخم الذي نلحظه ونشعر به، وهو ما يعادل تفجير 100 مليار طن من الديناميت في كل ثانية، وفقا لوكالة الفضاء ناسا.1
ولو حاولنا اعتباطا وافتراضا إخماد هذه الطاقة المشعّة، فإنّنا بحاجة إلى حوض سباحة تتجاوز مساحته 6 تريليونات كم مربع ممتلئ بالماء لصبّه على الشمس، وإن كنا نرى أنّ هذه الحيلة ستنطلي على الشمس بحكم معرفتنا المسبقة عن علاقة الماء والنار، فإننا على الأرجح مخطئون.
فالشمس لن تتأثر بأيّ كمية من الماء المسكوب عليها، بل على العكس سيساهم ذلك الأمر في إشعال الشمس وتزويدها بالوقود، لأن الماء مركب كيميائي يتكوّن من ذرتي هيدروجين وذرة أوكسيجين. وعندما يتبخر الماء بفعل الحرارة، فإنّ الهيدروجين سينضم إلى بقية ذرات الهيدروجين التي تمثل كتلة الشمس.
واستنادا إلى معادلة "أينشتاين" الشهيرة القائلة بأنّ ثمة علاقة وطيدة بين الكتلة والطاقة، فإنّا نجد بأن جميع الطاقة الشمسية المنبعثة ناتجة عن تفاعل كتلتها التي تتمثل بذرات الهيدروجين بنسبة 72%، وذرات الهيليوم بنسبة 26%، وأما النسبة الباقية فتمثلها بعض ذرات العناصر الأثقل مثل الأوكسيجين والكربون والنيتروجين والمغنسيوم والحديد والسيليكون.2
حقبة التيار الذري.. جذور النظرية في عصور الفلاسفة الإغريق
نجد أنفسنا اليوم نتحدث بثقة تامة عن التركيب الكيميائي للشمس وللأرض ولبقية الأجرام السماوية، وبخطوات جريئة وواثقة نستطيع التمييز بين العناصر والاختلاف الذرّي بين بعضها، وذلك ليس إلا نتاج عمل كبير من اكتشاف الذرّة وإجراء تجارب شتى عليها، لنتحقق من وجود النموذج الذرّي في الكون.
تشير النظرية الذرية إلى أنّ الكون بكل ما يحويه من مادة يتألف من جسيمات أو ذرات في غاية الصغر غير قابلة للقسمة أو التجزئة، وتعود جذور النظرية إلى عهد ما قبل الفيلسوف اليوناني "سقراط" في القرن الخامس قبل الميلاد، وقد شهدت تلك الحقبة ظهور التيار الذرّي (Atomism) الذي كان رائده الفيلسوف الإغريقي "ليوكيبوس" وتلميذه الشهير "ديموقريطوس"، كما ظهرت بعض النصوص الهندية القديمة تتحدث عن ذات المفهوم الذري للمادة تعود إلى ذات الحقبة.3
وعلى الرغم من ذلك، لم ينظر إلى النموذج الذري وإلى احتمالية وجود ذرات تشكّل المادة في الكون إلا في القرن التاسع عشر، حينما أتاح "النهج العلمي" فرصة لملاحظة وتجربة الجسيمات غير المرئية، وعندها فُتحت للإنسان خزائن عالم جديد ما زالت تدرّ عليه بالمعلومات وتبهره بالعجائب حتى اليوم.
نظرية التراكيب الذرية.. ثمرة التفاعلات الكيمائية للموائع
استطاع الكيميائي والفيزيائي الإنجليزي "جون دالتون" أن يخطّ أول معالم العالم الذرّي بشكل أكاديمي وصياغة علمية بعد إجرائه لعدة تجارب أفضت إلى وضعه نظرية حول التراكيب الذرية، وقد ألحقت باسمه بعد حين فأصبحت "نظرية دالتون للذرة".
وكان عمل "دالتون" في "جمعية مانشستر الأدبية والفلسفية" في عام 1800 قد نتجت عنه دراسات وأبحاث عدة عن التفاعلات الكيميائية للموائع، ومنها تجربته الشهيرة التي أجراها على مجموعة مختلفة من الغازات، مثل الأوكسيجين والهيدروجين والنيتروجين وغيره، وبحساب ناتج الضغط الذي تحدثه هذه الغازات مجتمعة في وعاء واحد، ومقارنتها بمجموع الضغط الذي تحدثه ذات الغازات وبذات الكمية، لكن على حدة؛ وجد "دالتون" أنّ الأرقام متساوية، وعليه تقدّم بورقته البحثية متحدثا عن قانونه، قانون "دالتون" للغازات.
وفي أثناء عمله على تجربته هذه، لاحظ "دالتون" بأنّ ثمة غازات لا يمكن الجمع بينها إلا بنسب معيّنة، وهو ما استدعاه إلى البحث ثمّ العمل على نظريته في التراكيب الذرية، وقد استند فيها على أمرين أساسيين.
تنص نظرية دالتون على أن العنصر الكيمائي يتكون من دقائق متناهية في الصغر، وغير قابلة للانقسام، تسمى الذرات،
أولهما قانون حفظ المادة، الذي صاغه الكيميائي الفرنسي "أنتوان لافوازييه" في عام 1789، وينص على أن الكتلة الكلية في أيّ تفاعل كيميائي تظل ثابتة، بمعنى آخر أنّ كتلة المواد المتفاعلة تساوي كتلة المواد الناتجة من التفاعل الكيميائي.
والقانون الآخر هو قانون النسب الثابتة، وقد أقرّه لأول مرّة الكيميائي الفرنسي "جوزيف لويس بروست" في عام 1799، وينص على أنّ أي مركب نقي يحتوي دائما على نفس النسب من العناصر المركبة له. فعلى سبيل المثال، ملح الطعام "كلوريد الصوديوم"، يحتوي على نفس النسبة بين عنصري الصوديوم والكلور بغض النظر عن كمية الملح أو مصدره.4
"نظرية دالتون".. خمس نقاط ثورية أسست لعلم الذرة الحديث
كانت مخرجات نظرية "دالتون" للذرة تتلخص في 5 نقاط ثورية وهي:
1. "جميع المواد تتكون من جسيمات تُدعى ذرات". وافترض "دالتون" بعض الصفات لهذه الجسيمات، مثل الصلابة وعدم القابلية للاختراق، وهنا يظهر جليا الخطأ الفادح الذي وقع به، ويُفهم السبب كون أنّ الأدوات العلمية لم تسعفه في ذلك الحين.
2. "ذرات أيّ عنصر معيّن تكون متطابقة في الكتلة والخصائص". فمثلا لن يكون هناك اختلاف بين أي ذرتين في الذهب النقي مهما بلغت كميته وكتلته، والعكس صحيح كذلك، فذرة الصوديوم تختلف عن ذرة الكربون. وقد تشترك بعض العناصر في عدة نقاط مثل درجة الغليان ودرجة الانصهار والتوصيل الكهربائي، ولكن لن يكون هناك تطابق مماثل بين ذرتي أي عنصرين مختلفين.
3. "يمكن التمييز بين ذرات العناصر المختلفة عن طريق حساب الأوزان الذرية".
4. "تتحد ذرات العناصر المختلفة، لتشكّل مركبات كيميائية متعددة، بصفات جديدة مغايرة". فملح الطعام مثلا يتركب من الصوديوم، وهو فلز قلوي شديد التفاعل مع الكلور، وهو غاز سام، ونتيجة تفاعلهما نحصل على مركب صالح للاستخدام تكاد لا تخلو مائدة طعام اليوم منه.
5. وأخيرا فإن "التفاعل الكيميائي ليس سوى إعادة ترتيب للذرات بين بعضها، ولا يمكن بأي شكل من الأشكال تدمير أو نفي أيّ ذرّة أو حتى تخليقها وإعادتها للطبيعة".5
لقد كانت استنتاجات "دالتون" مباشرة وعملية في صياغة المعادلات الكيميائية الخطية، إلا أنها افتقرت إلى الوصول إلى ما هو أدنى من الذرّة نفسها، فنجدها في هذا النموذج صلبة وغير قابلة للتجزئة، وبلا أي شحنة كهربائية. وهذا المفهوم الخاطئ استطاع أن يتداركه العالم البريطاني "أرنست رذرفورد" في القرن اللاحق.
"جوزيف تومسون".. صدفة اكتشاف جسيمات أصغر من الذرة
بعد نحو 100 عام، أقدم العالم البريطاني السير "جوزيف تومسون" على تجارب في الكهرباء والنشاط الإشعاعي، فنتج عن ذلك اكتشاف جسيمات أصغر من الذرة نفسها، وهي الإلكترونات، وقد أربك ذلك الحسابات في بادئ الأمر، إلا أنه دفعه في نهاية المطاف إلى تبني نموذج جديد للذرة، فبدلا من أن تكون جسما صلبا جامدا، أشار "تومسون" إلى أنّ ثمة مجموعة من الإلكترونات سالبة الشحنة تسبح في محيط ذرة ذي شحنات موجبة.
ففي عام 1897 أجرى "تومسون" تجربةً لاحظ بها أن أشعة الكاثود -وهو سيل من الأشعة يتأثر بالمجال المغناطيسي والكهربائي- تتكوّن من جسيمات غير معروفة سالبة الشحنة. وما لبث أن استنتج أنّ هذه الجسيمات ينبغي أن تكون أصغر بكثير من الذرّة، كما أن قيمة شحنتها تتناسب طرديا مع كتلتها.
سمى "تومسون" في البداية هذه الجسيمات "جسيمات دقيقة"، وقد لاحظ أن من الممكن استخلاصها من أيّ مادة، وقد تغيرت تسميتها لاحقا إلى ما نعرفه اليوم بالإلكترونات ومفردها إلكترون.6
حصل "تومسون" على جائزة نوبل في الفيزياء بعد 9 سنوات من اكتشافه، وقد بدا جليا بالنسبة له بأنّ جميع الذرات تحتوي على الإلكترونات، ولأنّ الذرات في المجمل ينبغي أن تكون محايدة في شحنتها، فإنّ اقتراح "تومسون" في وصف الذرة بأنّ ثمّة "بِركة" ذات شحنة موجبة تسبح فيها الإلكترونات سالبة الشحنة، فيحدث حينها التكافؤ. وجاء تشبيه هذا النموذج بحلوى البودينغ الإنجليزية (Plum Pudding) في محاولة للتبسيط.6
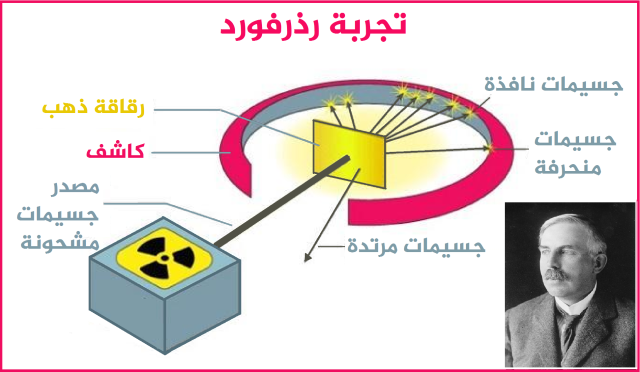
"أرنست رذرفورد".. تجربة رقاقة الذهب التي أنتجت نواة الذرة
على الرغم من التحوّل الكبير في المشهد، لم يصمد نموذج "تومسون" كثيرا مع بزوغ نجم العالم النيوزيلندي "أرنست رذرفورد"، وهو أحد طلاب "تومسون" السابقين، وذلك بعد إجرائه تجربة رقاقة الذهب الشهيرة (Gold Foil Experiment) التي نتج عنها اكتشاف نواة الذرة في عام 1911.
لاحظ "رذرفورد" بأنّ الموجات الموجبة لا تنتشر في جميع الذرة، بل إنّها تتمركز في حيّز ضيق في المنتصف، حيث تقع النواة، وعلى ضوء ذلك ظهر اكتشاف الجسيم دون الذري البروتون، وهو يعادل تماما شحنة الإلكترون إلا أنّه موجب الشحنة.
جاءت تجربة رذرفورد لتكشف عن النواة وشحنتها الموجبة وأن الذرة ليست جسما مصمتا كما افترض دالتون
لقد دفع "رذرفورد" بذلك إلى ترميم النموذج الذري الذي وضعه معلمه، بعد أن أطلق حزمة من جسيمات ألفا، وهي جسيمات موجبة الشحنة ذات كتلة أثقل بـ7000 مرّة من الإلكترون، على صفيحة رقيقة من الذهب، فوضعه في حيرة شديدة من أمره، ويُذكر أنّ "رذرفورد" علّق حينها: كان الأمر لا يُصدق، كما لو أنك أطلقت قذيفة ذات 15 بوصة على مناديل ورقية، فترتد القذيفة وتعود لترتطم بك.7
كشفت تجربة "رذرفورد" أنّ معظم جسيمات ألفا اجتازت نحو الطرف الآخر بعد اختراقها صفيحة الذهب، مما يشير بأنّ معظم الحيّز داخل الذرة عبارة عن فراغ. ولاحظ بأن بعض جسيمات ألفا قد انحرفت عن مسارها على نحو طفيف، مما قد يشير إلى إمكانية حدوث اصطدام بينها وبين جسيمات موجبة أخرى توجد معها في الذرة نفسها. بينما كانت هناك جسيمات ألفا انحرفت بشكل كبير، وجسيمات قليلة منها ارتدت نحو مصدر الإشعاع.
وكان استنتاجه هو أنّ هذا الأمر لا يحدث إلا إذا كانت ثمّة قوة تنافر هائلة ينتج عنها هذا الانحراف، ولتحقيق هذه القوة ينبغي أن تتمركز هذه الشحنة الموجبة في نقطة ما، لا أن تكون منتشرة في جميع أنحاء الذرة. ونتيجة لذلك اكتشف الجسيم دون الذري الآخر "البروتون"، وهو موجود داخل النواة، ويحمل شحنة موجبة مساوية لشحنة الإلكترون السالبة.
يصف نموذج "رذرفورد" الذرة بأن ثمّة نواة موجبة الشحنة تتوسطها، وحجم النواة صغير للغاية نسبيا، لكنها عالية الكثافة إذ تتركز بها معظم كتلة الذرة، وتدور حولها مجموعة من الإلكترونات سالبة الشحنة على مسافات معينة تحكمها القوة الكهروستاتيكية. وقد أسند "رذرفورد" نموذجه إلى النظام الشمسي، إذ شبّه النواة بالشمس، والإلكترونات هي الكواكب التي تدور حولها بفعل قوة الجاذبية.8
"نيلز بور".. نموذج يرضي الكيمياء ويعارض فيزياء الكم
لم تكن هذه المرّة الأولى التي يشبه فيها هيكل الذرّة بالنظام الشمسي، فقد سبق عدّة فيزيائيين بذات المقترح، وكان أشهرهم الياباني "هانتارو ناغاوكا"، لكن على أي حال لم يصمد نموذج "رذرفورد" هو الآخر طويلا، فبعد سنوات قليلة أقبل الفيزيائي الدنماركي "نيلز بور"، بالاشتراك مع "رذرفورد" نفسه على العمل على بعض التعديلات الجوهرية في النموذج السابق.
كان للنموذج الكوكبي للذرة عيبان مهمّان، الأول هو أنّه على عكس الكواكب، فإنّ الإلكترونات جسيمات مشحونة تتأثر بالمجال الكهرومغناطيسي. والمعضلة الأخرى تكمن في أن النموذج الكوكبي للذرة غير قادر على تفسير ظاهرتي انبعاث وامتصاص الأطياف العالية في الذرات.
جاء نموذج بور ليفسر حقيقة حركة الإلكترونات في مداراتها حول النواة وكيف تكسب أو تخسر طاقة
ومن حسن حظ الفيزيائي "بور" أن عهده قد تزامن مع بدء العمل على نظرية فيزياء الكم في مطلع القرن العشرين التي أحدثت ثورة عظيمة في العلوم الطبيعية لدى البشر عن كيفية عمل الكون، فقد اقترح العالمان الألمانيان "ماكس بلانك" و"ألبرت أينشتاين" أن الطاقة الضوئية تنبعث أو تُمتص على هيئة كميات منفصلة تُعرف بالكمّات (Quanta). وهو ما راق لـ"بور"، لكي يدمج هذا التعريف مع نموذج الذرّة، مما دفعه إلى استنتاج المخرجات الثلاثة التالية:
1. تدور الإلكترونات حول نواة الذرة في مدارات دائرية ذات طاقة معروفة.
2. ترتبط طاقة المدار ببعده عن النواة، بحيث تكون أقل مستويات الطاقة في المدارات الأقرب للنواة، والعكس صحيح.
3. ترسل الذرة إشعاعا أو تمتصه اعتمادا على حركة الإلكترون وتنقله بين المدارات.9
وبطبيعة الحال استند "بور" على ذرة الهيدروجين، لكونها أبسط وأخف الذرات الموجودة في الكون، إذ تحتوي على بروتون واحد داخل النواة، ويحوم حوله بالمقابل إلكترون واحد في مدار دائري، وفي حال انتقال الإلكترون من مدار إلى آخر فإنه إما أن يشع أو يمتص طاقة كهرومغناطيسية. وهذه المدارات لا تسمح إلا بوجود عدد محدود من الإلكترونات، بحيث أنه كلّما اتسع المدار، فإنّ عدد الإلكترونات المسموح بها يرتفع.
وعلى ما يبدو عليه نموذج "بور" بأنه هو أقرب النماذج وأبسطها للحقيقة، وقد بدا أكثر من كاف بالنسبة للكيميائيين للتعامل مع الذرات، فإنه لم ينل ثقة الفيزيائيين الذين رأوا أن النموذج ما زال يعاني من ثغرات تعارض مبادئ فيزياء الكم، وهو العلم الذي يدرس خصائص الجسيمات دون الذرية، وأهمها مبدأ عدم اليقين أو مبدأ الشك، وينص على أنّه لا يمكن قياس تموقع الجسيم وزخمه في نفس اللحظة على وجه الدقة، وإنما يصح التوقع فحسب.10
نموذج السحابة.. لغز حركة الإلكترون يكشف أسرار النواة
بعد أن حلّ الفيزيائي الشهير النمساوي "إرفين شرودينغر" خلفا للعالم "ماكس بلانك" في جامعة "فريدريش فيلهام" ببرلين، صبّ جل اهتمامه على آخر ما توصلت إليه النظرية الذرية، وبحكم ضلوعه العميق في فيزياء الكم، فقد سعى إلى تحويل النموذج الذري من مفهومه الكلاسيكي إلى صورته الحقيقية في فيزياء الكم.
وفي عام 1926 قدّم "شرودينغر" أوراقه البحثية لمعادلات رياضية تتناول احتمالية العثور على إلكترون في موقع معيّن في الذرة، وكانت هذه المعادلات مدخلا وحجر زاوية لنموذج الذرة بشكله الأخير الذي نعرفه اليوم. إذ أوضح "شرودينغر" بأنّ الإلكترون لا يدور حول النواة بحركة فيزيائية كلاسيكية، بل ثمّة عدّة مواقع تظهر على هيئة سحابة تطوّق نواة الذرة وتتنبأ بموقع الإلكترون، وكلّما زادت كثافة السحابة، زادت نسبة وجود الإلكترون. وتمتاز هذه السحابة بأنها تسمح بوجود الإلكترون في فضاء ثلاثي الأبعاد.11
شرودنغر يكتشف بأن الإلكترون لا يدور في مدار دائري واحد بل يمكن العثور عليه في سحابة من الاحتمالات
وهذا دون الحاجة إلى التعمق في المزيد من التفاصيل التي يصعب على غير المتخصصين الخوض فيها لأنها تتعامل مع العالم دون الذري كما أوضحنا سابقا، وهو ما يصعب تخيّله أو صياغته حتى رياضيا.
لم يمض كثير من الوقت حتى توصل العلماء إلى الجسيم الثالث من مكونات الذرة، فبعد الإلكترون والبروتون اكتشف النيوترون، وهو جسيم عديم الشحنة يوجد في نواة الذرّة. وعلى هذا النحو استطاع العلماء إقامة حجتهم النهائية حول هيكل الذرة الذي نعرفه اليوم، والذي لولاه لما تقدمت بنا التكنولوجيا وأنتجت ما نحمله اليوم من الصناعات الإلكترونيات الحديثة بمختلف صورها، وفي مقدمتها الهاتف المحمول.
المصادر:
[1] تشوي، تشارلز (2021). نجم الأرض: حقائق عن عمر الشمس وحجمها وتاريخها. تم الاسترداد من: https://www.space.com/58-the-sun-formation-facts-and-characteristics.html
[2] نفس المصدر.
[3] بولمان، بيرنارد (1998). الذرة في تاريخ الفكر البشري. أوكسفورد يونيفرسيتي برس، أوكسفورد. ص31
[4] ويليامز، مات (2014). ما هو النموذج الذري لجون دالتون؟. تم الاسترداد من: https://www.universetoday.com/38169/john-daltons-atomic-model/
[5] محررو الموقع (التاريخ غير معروف). نظرية دالتون للذرة. تم الاسترداد من: https://www.khanacademy.org/science/chemistry/electronic-structure-of-atoms/history-of-atomic-structure/a/daltons-atomic-theory-version-2
[6] محررو الموقع (التاريخ غير معروف). نموذج طومسون للذرة – نموذج بودنغ البرقوق. تم الاسترداد من: https://www.nuclear-power.com/nuclear-power/reactor-physics/atomic-nuclear-physics/atomic-theory/thomson-model-of-the-atom-plum-pudding-model/
[7] جوجريسون، إريك (التاريخ غير معروف). نموذج رذوفورد. تم الاسترداد من: https://www.britannica.com/science/Rutherford-model
[8] نفس المصر.
[9] هالمستين، آني ماري (2020). شرح نموذج بور للذرة. تم الاسترداد من: https://www.thoughtco.com/bohr-model-of-the-atom-603815
[10] محررو الموقع (التاريخ غير معروف). مبدأ عدم اليقين. تم الاسترداد من: https://www.britannica.com/science/uncertainty-principle
[11] ويليامز، مات (2016). ما هو نموذج السحابة الإلكترونية؟. تم الاسترداد من: https://www.universetoday.com/38282/electron-cloud-model/
https://doc.aljazeera.net/%D8%AA%D9%82%D8%A7%D8%B1%D9%8A%D8%B1/%D8%AA%D8%A7%D8%B1%D9%8A%D8%AE-%D8%A7%D9%84%D8%B0%D8%B1%D8%A9-%D8%A3%D8%B3%D8%B1%D8%A7%D8%B1-%D8%A7%D9%84%D8%AC%D8%B3%D9%8A%D9%85%D8%A7%D8%AA-%D8%A7%D9%84%D8%AF%D9%82%D9%8A%D9%82%D8%A9-%D8%A7%D9%84/?fbclid=IwAR1FoJ9d4a7kzYmt11QP2QPxnXyF9tuWrrdccrki0phmuVxBYYLSOcPCjNA