L'histoire de l'atome... les secrets des minuscules particules qui composent notre monde moderne
Le soleil n'est pas seulement la principale source d'énergie et de lumière pour notre planète, mais il domine avec sa majestueuse ampleur le système solaire avec tout ce qu'il contient de planètes, de lunes et de météorites.
Contrairement à ce qu'il semble dans le ciel d'immobilité et de stabilité, cette énorme masse est dans un état constant de frénésie et d'éruption représentée par l'énorme quantité d'énergie et de chaleur que nous remarquons et ressentons, ce qui équivaut à faire exploser 100 milliards de tonnes de dynamite chaque seconde, selon l'agence spatiale de la NASA. 1
Si nous essayons arbitrairement et supposons d'éteindre cette énergie rayonnante, nous avons besoin d'une piscine de plus de 6 000 milliards de kilomètres carrés remplie d'eau pour la déverser sur le soleil, et si nous pensons que cette astuce trompera le soleil en vertu de nos connaissance de la relation entre l'eau et le feu, nous nous trompons probablement.
Le schéma et le concept des incendies sur Terre sont complètement différents de ceux du Soleil, car les processus de génération de chaleur dépendent de la fusion nucléaire, par laquelle quatre atomes d'hydrogène fusionnent pour produire un atome d'hélium, en plus de l'énergie résultant de la processus de fusion.
Le soleil ne sera pas affecté par la quantité d'eau déversée dessus, au contraire, cela contribuera à l'enflammer et à lui fournir du carburant, car l'eau est un composé chimique composé de deux atomes d'hydrogène et d'un atome d'oxygène. Lorsque l'eau s'évapore à cause de la chaleur, l'hydrogène rejoindra le reste des atomes d'hydrogène qui composent la masse du soleil.
Selon la célèbre équation d'Einstein, qui dit qu'il existe une relation forte entre la masse et l'énergie, on constate que toute l'énergie solaire émise résulte de l'interaction de sa masse, qui est représentée par les atomes d'hydrogène à 72%, les atomes d'hélium à 26%, et le reste est représenté par certains atomes d'éléments plus lourds tels que l'oxygène, le carbone, l'azote, le magnésium, le fer et le silicium.
L'ère du courant atomique.. Les racines de la théorie à l'époque des philosophes grecs
Aujourd'hui, nous nous retrouvons à parler en toute confiance de la composition chimique du soleil, de la terre et du reste des corps célestes, et avec des pas audacieux et confiants, nous pouvons distinguer les éléments et la différence atomique entre eux, et ce n'est rien mais un grand travail de découverte de l'atome et de réalisation de diverses expériences sur celui-ci, pour vérifier l'existence du modèle atomique dans l'univers.
La théorie atomique indique que l'univers, avec tout ce qu'il contient de matière, se compose de très petites particules ou atomes indivisibles, et les racines de la théorie remontent à l'époque précédant le philosophe grec "Socrate" au cinquième siècle avant JC, et cette époque a vu l'émergence du courant atomique (atomisme), qui a été lancé par le philosophe grec "Leucippe" et son célèbre étudiant "Démocrite", et certains textes indiens anciens sont apparus parlant du même concept atomique de la matière datant du même ère. 3
Malgré cela, le modèle atomique et la possibilité de l'existence d'atomes constitutifs de la matière dans l'univers n'ont été envisagés qu'au XIXe siècle, lorsque la «méthode scientifique» a permis d'observer et d'expérimenter des particules invisibles, puis s'est ouverte à l'homme les trésors d'un monde nouveau qui lui apporte encore des informations et le fascine de merveilles jusqu'à aujourd'hui .
La théorie des structures atomiques.. le fruit des réactions chimiques des fluides
Le chimiste et physicien anglais John Dalton a pu écrire les premières caractéristiques du monde atomique de manière académique et scientifique après avoir mené plusieurs expériences qui l'ont conduit à développer une théorie sur les structures atomiques.
Le travail de Dalton dans la "Manchester Literary and Philosophical Society" en 1800 a abouti à plusieurs études et recherches sur les réactions chimiques des fluides, y compris sa célèbre expérience sur un groupe différent de gaz, tels que l'oxygène, l'hydrogène, l'azote et autres, et le calcul le produit de pression causé par ces gaz réunis dans un récipient, et en les comparant à la pression totale causée par les mêmes gaz et la même quantité, mais séparément ; « Dalton » a découvert que les nombres sont égaux, alors il a soumis son document de recherche, parlant de sa loi, la « loi de Dalton » des gaz.
En travaillant sur cette expérience, Dalton a remarqué qu'il existe des gaz qui ne peuvent être combinés que dans certaines proportions.
La théorie de Dalton stipule qu'un élément chimique est composé de particules indivisibles et infinitésimales appelées atomes.
La première est la loi de conservation de la matière, formulée par le chimiste français Antoine Lavoisier en 1789, qui stipule que la masse totale de toute réaction chimique reste constante, en d'autres termes, la masse des réactifs est égale à la masse des substances produit dans une réaction chimique.
L'autre loi est la loi des proportions constantes, approuvée pour la première fois par le chimiste français "Joseph Louis Proust" en 1799, et qui stipule que tout composé pur contient toujours les mêmes proportions de ses éléments composés. Par exemple, le sel de table "chlorure de sodium", contient le même rapport entre les éléments sodium et chlore, quelle que soit la quantité ou la source du sel. 4
"La théorie de Dalton".. Cinq points révolutionnaires qui ont établi la science atomique moderne
Les résultats de la théorie de l'atome de "Dalton" ont été résumés en 5 points révolutionnaires :
1. "Toute matière est faite de particules appelées atomes." Dalton a supposé certaines des caractéristiques de ces particules, telles que la dureté et l'impénétrabilité, et ici l'erreur fatale qu'il a commise devient apparente, et la raison est comprise parce que les outils scientifiques ne l'ont pas aidé à ce moment-là.
2. "Les atomes d'un élément donné sont identiques en masse et en propriétés." Par exemple, il n'y aura pas de différence entre deux atomes d'or pur, quelles que soient sa quantité et sa masse, et vice versa également.L'atome de sodium est différent de l'atome de carbone. Certains éléments peuvent partager de nombreux points tels que le point d'ébullition, le point de fusion et la conductivité électrique, mais il n'y aura pas de correspondance identique entre les atomes de deux éléments différents.
3. "Les atomes de différents éléments peuvent être distingués en calculant les poids atomiques."
4. "Les atomes des différents éléments se combinent pour former de multiples composés chimiques, avec des propriétés nouvelles et différentes." Le sel de table, par exemple, est composé de sodium, qui est un métal alcalin hautement réactif avec le chlore, qui est un gaz toxique.
5. Enfin, "la réaction chimique n'est rien d'autre qu'un réarrangement d'atomes entre eux, et il n'est en aucun cas possible de détruire ou de nier un atome, ou même de le recréer et de le rendre à la nature". 5
Les conclusions de Dalton étaient directes et pratiques dans la formulation d'équations chimiques linéaires, mais ils n'avaient accès à rien de moins que l'atome lui-même.Dans ce modèle, nous le trouvons solide, indivisible et sans aucune charge électrique. Cette idée fausse a été corrigée par le scientifique britannique "Ernest Rutherford" au siècle suivant.
"Joseph Thompson" .. La coïncidence de la découverte de particules plus petites que l'atome
Après environ 100 ans, le scientifique britannique Sir Joseph Thomson a fait des expériences sur l'électricité et la radioactivité, qui ont abouti à la découverte de particules plus petites que l'atome lui-même, qui sont des électrons, et cela a d'abord confondu les calculs, mais l'a finalement conduit à adopter une modèle Nouveau pour l'atome, au lieu d'être un corps solide et rigide, "Thomson" a indiqué qu'il existe un groupe d'électrons chargés négativement nageant à proximité d'un atome chargé positivement.
En 1897, Thomson a mené une expérience dans laquelle il a remarqué que les rayons cathodiques - un flux de rayons affectés par des champs magnétiques et électriques - sont constitués de particules inconnues chargées négativement. Il en conclut bientôt que ces particules devaient être beaucoup plus petites qu'un atome, et que la valeur de sa charge est directement proportionnelle à sa masse.
Thomson a initialement appelé ces particules "particules fines", et il a remarqué qu'elles pouvaient être extraites de n'importe quel matériau, et leur nom a ensuite été changé en ce que nous connaissons aujourd'hui sous le nom d'électrons et singulièrement électron. 6
Thomson a reçu le prix Nobel de physique 9 ans après sa découverte.Avec une charge positive dans laquelle nagent les électrons chargés négativement, la valence se produit. Ce modèle a été comparé au Plum Pudding anglais dans une tentative de simplification6.
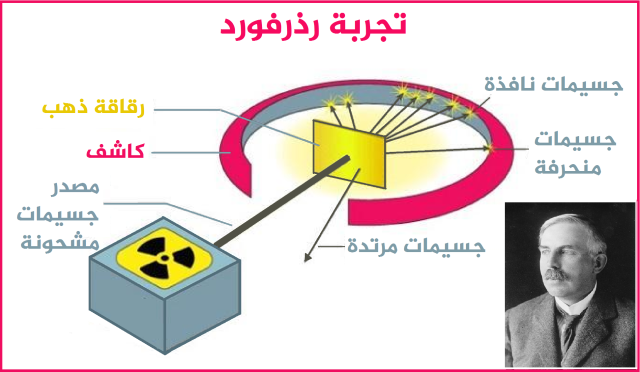
Ernest Rutherford... l'expérience de la feuille d'or qui a produit le noyau d'un atome
Malgré le changement radical de décor, le modèle de Thomson n'a pas beaucoup résisté à l'émergence de la star néo-zélandaise Ernest Rutherford, l'un des anciens élèves de Thomson, après avoir mené la célèbre expérience de la feuille d'or, qui a abouti à la découverte d'un noyau. 1911.
Rutherford a remarqué que les ondes positives ne se propagent pas dans tout l'atome, mais plutôt qu'elles se concentrent dans un espace étroit au milieu, où se trouve le noyau, et à la lumière de cela, la découverte de la particule subatomique, le proton, est apparue, qui est complètement égal à la charge de l'électron, mais il est chargé positivement.
L'expérience de Rutherford est venue révéler le noyau et sa charge positive, et que l'atome n'est pas un corps solide, comme le supposait Dalton.
Ainsi, Rutherford l'a incité à restaurer le modèle atomique de son professeur, après avoir tiré un faisceau de particules alpha, qui sont des particules chargées positivement avec une masse 7000 fois plus lourde qu'un électron, sur une fine feuille d'or, le rendant très confus. Rutherford a alors commenté : C'était incroyable, comme si vous aviez tiré un obus de 15 pouces sur un mouchoir, et que l'obus rebondissait et vous frappait. sept
L'expérience de Rutherford a révélé que la plupart des particules alpha sont passées à l'autre extrémité après avoir pénétré la plaque d'or, indiquant que la majeure partie de l'espace à l'intérieur de l'atome est un espace vide. Il a remarqué que certaines particules alpha étaient légèrement déviées de leur trajectoire, ce qui peut indiquer la possibilité d'une collision entre elles et d'autres particules positives trouvées avec elles dans le même atome. Bien qu'il y ait eu des particules alpha fortement déviées, quelques-unes ont rebondi vers la source de rayonnement.
Sa conclusion était que cela ne se produit pas à moins qu'il n'y ait une énorme force répulsive qui entraîne cette déviation, et pour atteindre cette force, cette charge positive doit être localisée en un point, et non répartie dans tout l'atome. En conséquence, il a découvert une autre particule subatomique, le "proton", qui est située à l'intérieur du noyau et porte une charge positive égale à la charge négative de l'électron.
Le modèle de Rutherford décrit l'atome comme ayant un noyau chargé positivement au milieu, et la taille du noyau est relativement petite, mais il est de haute densité, car la majeure partie de la masse de l'atome est concentrée, et un groupe d'électrons chargés négativement tournent autour de lui à certaines distances régies par la force électrostatique. Rutherford a basé son modèle sur le système solaire, en comparant le noyau au soleil, et les électrons sont les planètes qui tournent autour de lui en raison de la force de gravité. 8
Niels Bohr : Un modèle qui satisfait la chimie et s'oppose à la physique quantique
Ce n'était pas la première fois que la structure de l'atome était assimilée au système solaire, puisque plusieurs physiciens avaient précédé la même proposition, dont le plus célèbre était le japonais "Hantaro Nagaoka", mais en tout cas, le "Rutherford" Le modèle n'a pas duré longtemps non plus. Bohr, avec Rutherford lui-même, a travaillé sur des modifications substantielles du modèle précédent.
Le modèle planétaire de l'atome présentait deux défauts importants : le premier était que, contrairement aux planètes, les électrons étaient des particules chargées qui étaient affectées par le champ électromagnétique. L'autre problème est que le modèle planétaire de l'atome est incapable d'expliquer les phénomènes d'émission et d'absorption des spectres élevés dans les atomes.
Le modèle de Bohr est venu expliquer le fait que les électrons se déplacent sur leurs orbites autour du noyau et comment ils gagnent ou perdent de l'énergie
Il est heureux pour le physicien "Bohr" que son règne ait coïncidé avec le début des travaux sur la théorie de la physique quantique au début du XXe siècle, ce qui a entraîné une grande révolution dans les sciences naturelles de l'homme sur le fonctionnement de l'univers. Les scientifiques allemands "Max Planck" et "Albert Einstein" ont suggéré que l'énergie lumineuse est émise ou absorbée en quantités discrètes appelées quanta. Ce qui a fait appel à Bohr, pour combiner cette définition avec le modèle atomique, ce qui l'a amené à conclure les trois sorties suivantes :
1. Les électrons tournent autour du noyau d'un atome sur des orbites circulaires d'énergie connue.
2. L'énergie de l'orbite est liée à sa distance par rapport au noyau, de sorte que les niveaux d'énergie les plus bas se trouvent dans les orbites les plus proches du noyau, et vice versa.
3. L'atome émet ou absorbe un rayonnement en fonction du mouvement de l'électron et de son transfert entre les orbitales. 9
Bien sûr, Bohr s'est appuyé sur l'atome d'hydrogène, car c'est l'atome le plus simple et le plus léger de l'univers, car il contient un proton à l'intérieur du noyau, et un électron tourne autour de lui en retour sur une orbite circulaire, et dans le cas où le électron se déplace d'une orbite à l'autre, il rayonne ou absorbe de l'énergie électromagnétique. Ces orbites ne permettent qu'un nombre limité d'électrons d'exister, de sorte que plus l'orbite est grande, plus le nombre d'électrons autorisés est élevé.
Et il semble que le modèle de Bohr soit le modèle le plus proche et le plus simple de la vérité, et il semblait plus que suffisant pour que les chimistes traitent des atomes, il n'a pas gagné la confiance des physiciens qui ont vu que le modèle souffre encore de lacunes qui contredisent le principes de la physique quantique, qui est la science qui étudie les propriétés des particules subatomiques, dont la plus importante est le principe d'incertitude ou le principe d'incertitude, qui stipule qu'il n'est pas possible de mesurer avec précision la position et l'impulsion d'une particule à la même moment, mais seule la prédiction est correcte. dix
Modèle de nuage.. Le mystère du mouvement des électrons révèle les secrets du noyau
Après que le célèbre physicien autrichien Erwin Schrödinger ait succédé à Max Planck à l'Université Friedrich Wilhelm de Berlin, il a concentré son attention sur les dernières découvertes de la théorie atomique et, en vertu de sa profonde implication dans la physique quantique, il a cherché à transformer le modèle atomique à partir de son concept. Classique à sa vraie forme en physique quantique.
En 1926, "Schrödinger" a présenté ses documents de recherche sur les équations mathématiques traitant de la probabilité de trouver un électron à un endroit spécifique de l'atome, et ces équations ont été une entrée et la pierre angulaire du modèle atomique dans sa forme finale que nous connaissons aujourd'hui. Schrödinger a expliqué que l'électron ne tourne pas autour du noyau dans un mouvement physique classique, mais qu'il existe plusieurs emplacements qui apparaissent sous la forme d'un nuage qui entoure le noyau de l'atome et prédit l'emplacement de l'électron. L'avantage de ce nuage est qu'il permet l'existence de l'électron dans un espace tridimensionnel. 11
Schrödinger découvre que l'électron ne tourne pas sur une seule orbite circulaire mais peut être trouvé dans un nuage de possibilités
Ceci sans qu'il soit nécessaire d'approfondir des détails difficiles à aborder pour les non-spécialistes car ils traitent du monde subatomique comme nous l'avons expliqué précédemment, ce qui est difficile à imaginer ou à formuler même mathématiquement.
Il n'a pas fallu longtemps aux scientifiques pour atteindre la troisième particule des composants de l'atome.Après l'électron et le proton, on a découvert le neutron, qui est une particule sans charge trouvée dans le noyau de l'atome. De cette manière, les scientifiques ont pu établir leur argument final sur la structure de l'atome que nous connaissons aujourd'hui, sans laquelle la technologie ne nous aurait pas fait progresser et produit ce que nous portons aujourd'hui des industries électroniques modernes sous toutes ses formes, en particulier le mobile téléphoner.
Sources:
[1] Choi, Charles (2021). Earth's Star: faits sur l'âge, la taille et l'histoire du soleil . Extrait de : https://www.space.com/58-the-sun-formation-facts-and-characteristics.html
[2] Même source.
[3] Pullman, Bernard (1998). L'atome dans l'histoire de la pensée humaine. Presse universitaire d'Oxford, Oxford. p 31
[4] Williams, Matt (2014). Quel est le modèle atomique de John Dalton ? Extrait de : https://www.universetoday.com/38169/john-daltons-atomic-model/
[5] Editeurs du site (date inconnue). La théorie de l'atome de Dalton. Extrait de : https://www.khanacademy.org/science/chemistry/electronic-structure-of-atoms/history-of-atomic-structure/a/daltons-atomic-theory-version-2
[6] Editeurs du site (date inconnue). Modèle de maïs de Thomson - Le modèle du pudding aux prunes. Extrait de : https://www.nuclear-power.com/nuclear-power/reactor-physics/atomic-nuclear-physics/atomic-theory/thomson-model-of-the-atom-plum-pudding-model/
[7] Jogrison, Eric (date inconnue). modèle Ruthford. Extrait de : https://www.britannica.com/science/Rutherford-model
[8] La même Égypte.
[9] Halmstein, Annie Marie (2020). Explication du modèle de Bohr de l'atome. Extrait de : https://www.thinktco.com/bohr-model-of-the-atom-603815
[10] Editeurs du site (date inconnue). Principe incertain. Extrait de : https://www.britannica.com/science/uncertainty-principle
[11]Williams, Matt (2016). Qu'est-ce que le modèle cloud ? Extrait de : https://www.universetoday.com/38282/electron-cloud-model/
https://doc.aljazeera.net/%D8%AA%D9%82%D8%A7%D8%B1%D9%8A%D8%B1/%D8%AA%D8%A7%D8%B1%D9%8A%D8%AE-%D8%A7%D9%84%D8%B0%D8%B1%D8%A9-%D8%A3%D8%B3%D8%B1%D8%A7%D8%B1-%D8%A7%D9%84%D8%AC%D8%B3%D9%8A%D9%85%D8%A7%D8%AA-%D8%A7%D9%84%D8%AF%D9%82%D9%8A%D9%82%D8%A9-%D8%A7%D9%84/?fbclid=IwAR1FoJ9d4a7kzYmt11QP2QPxnXyF9tuWrrdccrki0phmuVxBYYLSOcPCjNA